С.О. Крамарьов, д.мед.н., професор, завідувач кафедри,
Л.В. Закордонець, к.мед.н., асистент, кафедра дитячих інфекційних хвороб, Національний медичний університет імені О.О. Богомольця, м. Київ
Кашель – одна з найбільш частих причин звернення батьків до педіатра. У переважній більшості випадків кашель у дітей пов’язаний із захворюваннями респіраторної системи. У статті представлені дані про етіологічну структуру гострих респіраторних інфекцій, механізми дії, ефективність та безпеку застосування карбоцистеїну (препарату Флюдітек) у комплексному лікуванні захворювань органів дихання у дітей.
Ключові слова: кашель, діти, мукоактивні препарати, карбоцистеїн, Флюдітек.
Враховуючи високий рівень захворюваності та летальності, гострі респіраторні захворювання (ГРЗ) до сьогодні залишаються актуальною проблемою медицини [26]. ГРЗ трапляються у всіх вікових групах, однак переважають у дитячому віці і є основною причиною госпіталізації дітей до 5 років життя (від 40,0 до 55,6% серед усіх госпіталізованих) [1]. Віруси викликають від 33,4% до 90,2% ГРЗ, і в таких випадках говорять про гострі респіраторні вірусні інфекції (ГРВІ). Частота виділення вірусів залежить від регіону, сезону та лабораторних методів діагностики: при застосуванні «традиційних» методів (реакції імунофлюоресценції та імуноферментного аналізу) віруси в змивах виявляють у 49% дітей із ГРЗ, а при використанні полімеразної ланцюгової реакції (ПЛР) цей показних зростає до 83% (переважно за рахунок виділення метапневмовірусів, коронавірусів, ентеровірусів) [21]. Цікавим є той факт, що при застосуванні ПЛР частота виділення респіраторних вірусів була приблизно однаковою у дітей при наявності симптомів ГРЗ та при їх відсутності (у 41,7-42,0% дітей) [20, 21].
Найчастіше при ГРВІ виділяють віруси грипу, парагрипу, риновіруси, аденовіруси, респіраторно-синцитіальні віруси, коронавіруси. В останнє десятиріччя завдяки зростанню можливостей лабораторної діагностики у хворих із ГРВІ почали виділяти нові віруси: метапневмовірус, бокавірус, 4 нових коронавіруси (SARS-CoV, HCoV-NL63, HCoV-HKU1, MERS-CoV), нові ентеровіруси (HEV), пареховірус (HPeV) [2, 3]. При ураженні верхніх дихальних шляхів метапневмовіруси та бокавіруси виділяють у поодиноких випадках (1,6 та 1,9% відповідно) [4]. Однак у дітей із пневмоніями частота виділення цих вірусів значно зростає: бокавірус виділяється у 24,1% хворих, а метапневмовірус – у 18,2% хворих [5]. Коінфекція двома та більше вірусами спостерігалася у 18,6%-40,4% пацієнтів із ГРЗ [3, 6, 7, 8, 13].
Одночасне інфікування кількома штамами респіраторних вірусів достовірно не обтяжувало перебіг захворювання [3]. В етіологічній структурі ГРВІ вірус грипу у дорослих посідав перше місце (виділявся у 20,6-53,8% хворих) [7, 9], а у дітей – друге, поступаючись респіраторно-синцитіальним вірусам та риновірусам [11].
Щорічно у світі від ГРЗ, що викликані вірусом грипу, помирає близько 650 000 людей, із них 28 000-111 500 випадків припадає на дітей перших п’яти років життя [10-12]. Для грипу характерні щорічні сезонні підвищення рівня захворюваності, однак періодично це захворювання досягає масштабів пандемії з високим рівнем летальності. У цьому сезоні в Україні рівень захворюваності на грип, на відміну від двох попередніх сезонів, не значно перевищив епідемічний поріг (рис. 1). У віковій структурі серед хворих на ГРІ частка дитячого населення становить 66,7%, а дорослого населення – 33,3%.
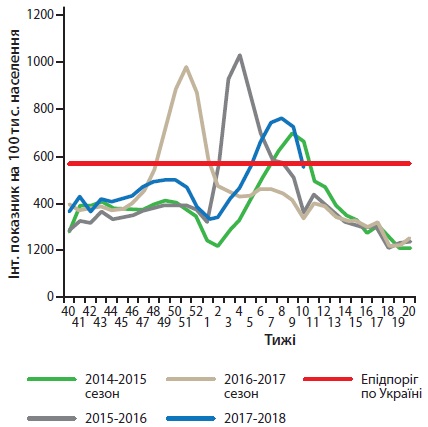
Рисунок 1. Рівень захворюваності на грип в Україні з 2014 по 2018 роки [39]
У цьому сезоні в зразках матеріалів від пацієнтів із підозрою на грип домінував грип типу В (табл. 1).
| Показники | Сезон 2017-2018 |
|---|---|
| Кількість досліджених зразків матеріалу | 2115 |
| Наявність РНК вірусу грипу загалом | 640 (30,3%) |
| А | 31 (4,8%) |
| A(H1N1)pdm09 | 9 |
| A(H3N2) | 6 |
| A несубтиповані | 16 |
| B | 609 (95,2%) |
Близько 10% ГРЗ викликаються бактеріями: Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, β-гемолітичним стрептококом, Mycoplasma pneumoniae, Chlamydia pneumoniae, Moraxella catarhalis тощо [2].
Кашель є одним із основних симптомів ураження дихальних шляхів при ГРЗ. У 50% хворих при ГРЗ кашель зникає до 10-го дня, однак у 10-25,7% пацієнтів він зберігається понад 3 тижні [14, 16, 20]. У 10,5% дітей кашель має рецидивний перебіг (більше 4 епізодів протягом 12 місяців) [20]. Залежно від тривалості розрізняють гострий кашель (триває до 3 тижнів), затяжний кашель (триває від 3 до 8 тижнів) та хронічний кашель (зберігається понад 8 тижнів). Американська колегія торакальних лікарів рекомендує у дітей хронічним вважати кашель, який зберігається понад 4 тижні [19].
Кашель – це рефлекторний акт, що виникає у відповідь на подразнення чутливих рецепторів nervus vagus, розташованих в органах дихання. Центр кашльового рефлексу розміщений у довгастому мозку, а еферентна частина представлена дихальними м’язами. Кашель є захисним механізмом, який сприяє видаленню з дихальних шляхів надлишкового секрету бронхіальних залоз та сторонніх тіл. Кашель також може виникати при подразненні механорецепторів зовнішнього слухового проходу, барабанної перетинки, плеври, перикарду [42].
Періодичне покашлювання протягом дня є нормальним фізіологічним процесом, спрямованим на очищення дихальних шляхів. Здорові діти можуть покашлювати до 11 разів протягом дня [24]. Проживання в екологічно забруднених регіонах збільшує частоту сухого кашлю у здорових дітей в 1,4 рази [23]. При ГРЗ частота кашлю може зростати до 140 епізодів на добу [22].
Збільшення частоти кашлю вказує на зміну реологічних властивостей бронхіального секрету, порушення мукоциліарного транспорту та на неспроможність фізіологічних механізмів очищувати дихальні шляхи [4]. Причинами гострого кашлю є ГРЗ, синусити, алергічні та неалергічні риніти, пневмонії, кашлюк, аспірація стороннього тіла [17]. Затяжний кашель частіше є наслідком перенесеного ГРЗ, кашлюка, бактеріального синуситу, інколи хронічного риносинуситу або аденоїдиту. Хронічний кашель може бути при хронічних захворюваннях бронхолегеневої системи (хронічні бронхіти, бронхоектази, хронічні обструктивні захворювання легенів), при затяжних бактеріальних бронхітах, хронічних риносинуситах, аденоїдитах, астмі, муковісцидозі, гастроезофагеальному рефлюксі, вроджених вадах серця, курінні (активному та пасивному), туберкульозі, саркоїдозі, нейром’язових порушеннях чи мати психогенну природу [17, 18].
Відповідно до міжнародних рекомендацій медикаментозне лікування кашлю у дітей показано тільки в тих випадках, коли він погіршує якість життя, самопочуття і стан як самого хворого, так і його батьків [28]. За даними літератури, кашель при ГРЗ заважає повсякденній активності у 76% дітей, порушує сон у 88% дітей та у 72% батьків [22]. Цікаво, що проявляти занепокоєння стосовно кашлю при ГРЗ 71,7% дорослих починають тільки після 7-го дня від початку захворювання, однак 76,7% дорослих починають раніше і більше хвилюватися, якщо у їхніх дітей виникає кашель [36]. На 2-3-й день після появи кашлю 33,4% дорослих звертаються до лікаря, 20,9% купують ліки за порадами фармацевтів і 23,1% лікуються самостійно. До 70,0% дорослих впевнені в ефективності застосування протикашльових та муколітичних препаратів при лікуванні кашлю. В країнах Європи найчастіше при самолікуванні інфекцій нижніх дихальних шляхів дорослі застосовували парацетамол (21,3%), протикашльові препарати (15,4%) і муколітики (14,7%) [37]. Після консультації лікаря цим пацієнтам найчастіше призначали муколітики (17,8%), протикашльові препарати (17,4%) та бронходилататори (14,6%) [37]. Таким чином, проблема ефективного та безпечного застосування муколітичних препаратів турбує не лише фахівців, а і все населення.
Мукоактивні препарати насамперед застосовують для відновлення реологічних властивостей слизу та нормалізації мукоциліарного транспорту. Залежно від механізму дії мукоактивні препарати поділяють на такі групи: експекторанти, муколітики, мукокінетики, мукорегулятори (табл. 2) [25].
| Препарати | Механізм дії |
|---|---|
| Експекторанти | |
| Гіпертонічний розчин | Збільшує об’єм бронхіального секрету |
| Гвайфенізин | Стимулює секрецію бронхіального слизу, зменшує в’язкість мокротиння |
| Йодидумісні сполуки | Збільшують секрецію рідини в дихальних шляхах |
| Модулятори іонних каналів | Збільшують вміст внутрішньоклітинного кальцію, поліпшуючи мукоциліарний транспорт |
| Муколітики | |
| N-ацетилцистеїн | Розриває дисульфідні «містки», що зв’язують полімери муцину; має антиоксидантний і протизапальний ефекти; збільшує секрецію хлоридів, розриває дисульфідні «містки» |
| Ердостеїн | Модулює продукцію мокроти; нормалізує мукоциліарний транспорт |
| Дорназа-α | Гідролізує ДНК бронхіального слизу; зменшує в’язкість мокротиння |
| Гельзолін | Розриває перехресні зв’язки ниток актину |
| Тимозин β4 | Розриває перехресні зв’язки ниток актину |
| Декстран | Розриває зв’язки між атомами водню; збільшує утворення золю |
| Гепарин | Розриває зв’язки між атомами водню й іонів |
| Мукорегулятори | |
| Карбоцистеїн | Впливає на метаболізм келихоподібних клітин; має антиоксидантний і протизапальний ефекти, модулює продукцію мокротиння; зменшує об’єм секрету |
| Холінолітики | Зменшують ендобронхіальне запалення і продукцію муцину |
| Глюкокортикоїди | Зменшують ендобронхіальне запалення і продукцію муцину |
| Макроліди | Зменшують запалення та секрецію муцину |
| Мукокінетики | |
| Бронхолітики | Поліпшують бронхіальний кліренс за рахунок підвищення швидкості повітряного потоку на видиху |
| Сурфактанти | Зменшують адгезію мокротиння/слизу |
| Амброксол | Стимулює продукцію сурфактанту і пригнічує нейрональні Nа+-канали, має антиоксидантний ефект |
Відхаркувальні засоби збільшують об’єм мокротиння і при недостатності кашльового рефлексу можуть порушувати дренажну функцію бронхів. Відхаркувальні препарати рослинного походження не рекомендують застосовувати у дітей до 2 років життя [12]. У частини пацієнтів вони підсилюють діяльність блювального і дихального центрів довгастого мозку, можуть викликати алергічні реакції. Крім того, «рослинні» препарати (аніс, солодка, материнка) можуть мати додатковий проносний ефект, що несприятливо впливає на самопочуття дитини.
Гіпертонічні розчини у вигляді інгаляцій виявились ефективними лише при муковісцидозі, але їх ефективність була нижчою, ніж у дезоксирибонуклеази [22].
З обережністю треба ставитися і до застосування у дітей із ГРЗ таких засобів, як йодид калію, гідрокарбонат натрію, оскільки вони стимулюють відхаркування за рахунок транссудації плазми і посилення перистальтики дрібних бронхів, що, своєю чергою, провокує розвиток синдрому бронхіальної обструкції [25].
Активність муколітиків пов’язана з порушенням дисульфідних зв’язків між молекулами кислих мукополісахаридів і глікопротеїдів мокротиння, завдяки чому воно стає менш в’язким і легше відходить. Особливістю механізму дії муколітиків є те, що, розріджуючи мокротиння, вони практично не збільшують його об’єм. Прикладом препаратів з цієї групи є ацетилцистеїн (АЦЦ).
Представником мукокінетиків є амброксол. Він стимулює продукцію сурфактанту, розріджує бронхіальний секрет шляхом розщеплення в ньому кислих мукополісахаридів та дезоксирибонуклеїнових кислот, блокує нейронні натрієві канали і активує мукоциліарний транспорт [38].
Мукорегулятор карбоцистеїн відрізняється від інших мукоактивних препаратів багатогранністю фармакологічних ефектів. Мукорегуляторний ефект карбоцистеїну пов’язаний з активацією сіалової трансферази – ферменту келихоподібних клітин слизової оболонки бронхів, які формують склад бронхіального секрету. Карбоцистеїн відновлює в’язкість та еластичність бронхіального секрету, активізує діяльність миготливого епітелію і поліпшує стан мукоциліарного кліренсу. Також карбоцистеїн може регулювати синтез слизу завдяки зменшенню кількості та гіперплазії келихоподібних клітин слизових оболонок дихальних шляхів. Таким чином, препарат має мукорегуляторну та муколітичну активність. Дія карбоцистеїну поширюється на всі відділи респіраторного тракту і додаткові пазухи носу.
У зв’язку з тим, що карбоцистеїн зменшує утворення слизу в бронхах, його небажано застосовувати з іншими лікарськими засобами, що пригнічують секреторну функцію бронхіальних залоз (протикашльові препарати центральної дії, макролідні антибіотики, антигістамінні препарати I покоління), не є виправданим його застосування і при невеликій кількості бронхіального секрету [40].
Карбоцистеїн має противірусну активність, яка проявляється в пригніченні адгезії та реплікації респіраторних вірусів. M. Yamaya (2010) встановив, що карбоцистеїн пригнічує проникнення і реплікацію вірусу сезонного грипу А в культурі клітин трахеального епітелію людини шляхом зниження щільності поверхневих рецепторів, відповідальних за взаємодію з вірусом грипу А, і перешкоджає виходу віріону в цитоплазму.
Схожий ефект карбоцистеїн має стосовно риновірусів та респіраторно-синцитіальних вірусів: пригнічує проникнення віріонів в епітеліальні клітини шляхом зниження мембранної експресії рецепторів вірусів (ICAM-1) та гальмує реплікацію вірусів у клітинах людської трахеї [34].
За рахунок руйнування рецепторів ICAM карбоцистеїн зменшує адгезію деяких бактерій до епітеліальних клітин дихальних шляхів (Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis) [29, 30, 28]. Завдяки цьому ефекту препарат показав високу ефективність у мета-аналізі при тривалому (12 місяців та більше) застосуванні у 1357 хворих із хронічними захворюваннями органів дихання, знизивши майже в 2 рази частоту ГРЗ та частоту загострень і поліпшивши якість життя [35].
Під дією карбоцистеїну збільшується рівень секреторного IgA та неспецифічних факторів захисту, що зміцнює місцевий імунітет, прискорює одужання при ГРЗ та запобігає приєднанню вторинної інфекції [2, 29].
Протизапальна активність карбоцистеїну проявляється у зниженні продукції прозапальних цитокінів (інтерлейкіну-1β, -6, -8), зменшенні міграції нейтрофілів, макрофагів та еозинофілів у вогнище запалення [34, 35]. Крім того, карбоцистеїн значно знижує оксидативний стрес, збільшуючи внутрішньоклітинний вміст хлоридів і глутатіону [25, 35], які перешкоджають розвитку оксидативного стресу або послаблюють його негативні наслідки [34]. При цьому зменшується утворення вільних радикалів, що сприяє захисту епітеліальних клітин від руйнування.
На сьогодні у багатьох країнах світу карбоцистеїн є одним із муколітичних препаратів, які призначаються найчастіше [35]. В мета-аналізі 6 рандомізованих клінічних досліджень (РКД) з участю 497 дітей із гострими інфекціями верхніх і нижніх дихальних шляхів без хронічної бронхо-легеневої патології була доведена ефективність застосування карбоцистеїну та ацетилцистеїну у дітей від 2 років у порівнянні з плацебо [41]. В цьому ж мета-аналізі 34 РКД (2064 пацієнтів) підтвердили високий профіль безпеки застосування карбоцистеїну та ацетилцистеїну у дітей від 2 років.
Брендовим препаратом карбоцистеїну є Флюдітек. Було показано, що при його застосуванні у 37 дітей із ГРВІ, яка ускладнилася бронхітом, збільшувалося місцеве продукування секреторного IgA (sIgA). Так, вміст sIgA у слині до початку лікування карбоцистеїном був нижчим за норму і становив 49,70 ± 1,83 мг/л. На тлі терапії карбоцистеїном рівень sIgA у слині збільшився в 4 рази (до 212 ± 0,02 мг/л, р < 0,05) і залишався високим (180 ± 0,01 мг/л) протягом року у половини з цих дітей [31]. При цьому відсоток дітей із нормальним рівнем sIgA після 8-10-денного курсу Флюдітеку збільшився з 20 до 87%. Із 30 дітей групи порівняння, які отримували відхаркувальні рослинні препарати (солодка, алтей, термопсіс) як допоміжну терапію, у динаміці рівень sIgA в слині залишався зниженим у 2/3 пацієнтів, при цьому середні показники знизилися зі 100,25 ± 0,50 мг/л до 73,9 ± 0,01 мг/л.
Препарат Флюдітек показав високу ефективність при лікуванні дітей із гострим ринітом на тлі хронічного аденоїдиту, у яких тривало зберігається кашель внаслідок виникнення синдрому постназального затікання слизу. При застосуванні Флюдітеку у цих хворих (36 дітей віком від 3 до 8 років) швидко зменшувалася в’язкість слизу (вже з 2-3-го дня лікування), поліпшувався його дренаж, що сприяло відновленню носового дихання [32]. Кашель у 88,2% дітей зникав до 7-го дня лікування Флюдітеком. У контрольній групі з 22 дітей, які отримували лише «традиційну» терапію, в’язкість слизу починала зменшуватися на 5-6-й день, а кількість секрету і кашель – на 6-7-й день.
Н.А. Соловйова зі співавторами (2013) порівняли терапевтичну ефективність препаратів карбоцистеїну (Флюдітек) і ацетилцистеїну (АЦЦ) при лікуванні ГРЗ у дітей. Пацієнти основної групи додатково до базисної терапії отримували карбоцистеїн (протягом 7 днів), а пацієнти контрольної групи – АЦЦ. Вже на 3-й день лікування у всіх пацієнтів основної групи спостерігався виражений клінічний ефект: значно поліпшилося носове дихання, полегшилося відходження слизу, у 63% хворих із бронхітом кашель змінився з непродуктивного на продуктивний. У контрольній групі на 3-й день лікування поліпшення симптомів виявлялося лише у 35% пацієнтів, а клінічний ефект спостерігався на 5-й день лікування [33].
Таким чином, завдяки мукорегуляторним, противірусним, імуномодулювальним, протизапальним та антиоксидантним властивостям карбоцистеїн (Флюдітек) має переваги при лікуванні гострих захворювань органів дихання перед іншими муколітичними препаратами. Високий профіль безпеки дає підстави рекомендувати цей препарат для застосування в дитячій практиці, починаючи з перших днів ГРЗ.
Склад лікарського засобу: діюча речовина: карбоцистеїн (carbocisteine);
Флюдітек 2 %: 1 мл сиропу містить 20 мг карбоцистеїну;
Флюдітек 5 %: 1 мл сиропу містить 50 мг карбоцистеїну.
Лікарська форма. Сироп.
Фармакотерапевтична група. Засоби, які застосовують при кашлі та застудних захворюваннях. Муколітичні засоби. Карбоцистеїн. Код АТС R05С В03.
Показання для застосування. Лікування симптомів порушень бронхіальної секреції та виведення мокротиння, особливо при гострих бронхолегеневих захворюваннях, наприклад при гострому бронхіті; при загостреннях хронічних захворювань дихальної системи.
Протипоказання.
Флюдітек 2%.
Флюдітек 5%.
Спосіб застосування та дози.
Флюдітек 2 %: Діти віком від 2 до 5 років - по 1 доз. ст., наповненому до відмітки 5 мл, 2 рази на день; Діти віком від 5 років до 15 років - по 1 доз. ст., наповненому до відмітки 5 мл, 3 рази на день. Флюдітек 5 %: по 1 дозувальному стаканчику, наповненому до відмітки 15 мл, 3 рази на день.
Побічні ефекти.
Флюдітек 2 %:
Флюдітек 5 %:
Категорія відпуску. Без рецепта.
Реєстраційні посвідчення:
Флюдітек, сироп 5% РП № UA/8082/01/02/01 Наказ МОЗ №1422 від 01.08.2018.
Флюдітек, сироп 2% РП № UA/8082/01/01 Наказ МОЗ №1422 від 01.08.2018.
Виробник. Іннотера Шузі, Франція/Innothera Chouzy, France.
Повна інформація про препарат міститься в інструкції для медичного застосування препарату.
Матеріал для розповсюдження в рамках спеціалізованих семінарів, конференцій, симпозіумів з медичної тематики та у спеціалізованих виданнях, призначених для медичних та фармацевтичних працівників.
До списку статей